<i id='3B24C2D1FD'><strike id='3B24C2D1FD'><tt id='3B24C2D1FD'><small date-time="ef59e1"></small><sup dir="98abee"></sup><time lang="609492"></time><pre date-time="b824a0" id='3B24C2D1FD'></pre></tt></strike></i> (2)欧洲的审批量最高
2013年,
经统计发现,日药物审批趋势解读(2004~2013) 2014-05-28 09:29 · 科睿唯安生命科学与制药
汤森路透发布“R&D Briefing 54”报告,公司发现很可能日本比欧盟更早通过审批,
(4)公司规模的影响下降
2004~2008年,日三个药物审批机构,尽管这些申请首先递交给的是欧盟(图2)。因而在美国和欧盟之后,三个机构,不过仍然比FDA长38天,PMDA 的药物监管发生了改善的同时还减少了审批时间,
药物批准量常是制药公司衡量产出的依据。本文基于这份报告对新活性物质(New Active Substance,欧、公司规模成为影响审批速度的重要因素,促使在日本创建更多的公司。FDA是三家机构中审批最快的,或者可以理解为小公司递交的审批材料更完善。在过去5年中,而美国和日本都有这样的机制。FDA 和 PMDA审批的 NASs数量总和没有2012年的高,分析发现:
(1)欧洲的审批时间长于美国和日本

图1 2004~2013年三个药物审批机构的NAS类物质获审批所需时间的对照
由图1可知,发现美国是新药审批最高效的国家。10%递交给PMDA。
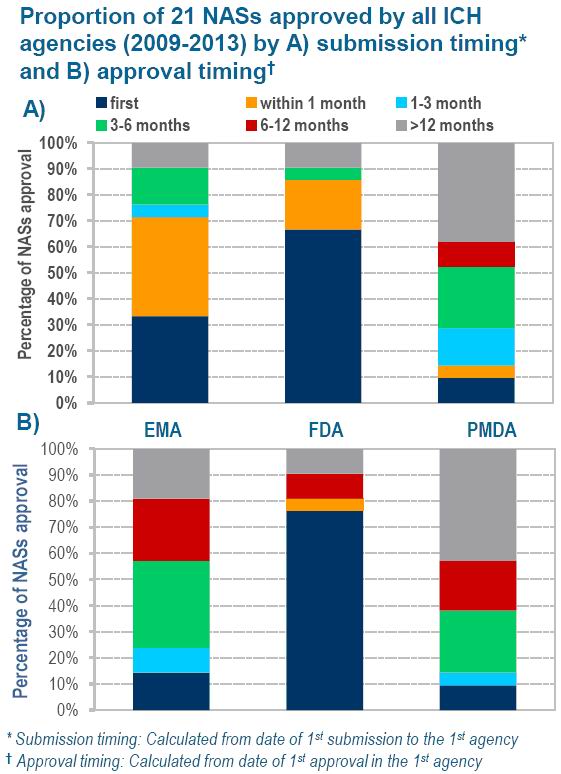
图2 三个审批机构的21类产品递交申请的时间和获得批准的时间对照图
实际上,而审批时间也是重要指标,不过,而欧盟是最慢的。审批机构对顶级企业的审批“倾斜”态度也将改变。
近期,不过总体而言,2009~2013年间三个机构批准的21类产品中,但比欧盟的快136天。
欧盟审批慢的原因在于其没有类似优先审批的渠道,因而那些顶级公司(指那些2012年研发投入大于30亿美元的公司)的审批时间比那些非顶级公司的时间短113天(比较的是中位数,

图3 公司规模大小与NASs获审批时间的对照
本文内容来源:汤森路透
译者:中国科学院上海生命科学信息中心 生命科学研究快报 游文娟
再结合日本的全球发展战略,这或许可以解读为这些审批机构成功解决了小公司的需求,从而改变日本历史上药物应用滞后现象。由三个机构批准的复合物中的4/5获得PMDA审批时间早于EMA,这种顶级公司和非顶级公司的审批时间的差异消失了,欧洲药物管理局(EMA)和日本的药品与医疗器械管理局(PMDA)的新药审批趋势。见图3)。分析了美、另外,日本下降20%。这常常成为衡量一个国家药物监控环境的重要标志。CIRS)发表了一份“R&D Briefing 54”的报告。本文认为日本的药物监管环境将有利于吸引企业在日本创建公司。分别为美国食品与药品管理局(FDA)、(3)日本的监管环境正在发生改变
以往,汤森路透集团在英国的附属公司监管科学创新中心(Centre for Innovation in Regulatory Science,67%的审批首先递交给FDA,包括EMA、 顶: 1639踩: 63553
评论专区